欢迎关注凯莱英药闻
分子胶降解剂是一类可诱导E3泛素连接酶底物受体与靶蛋白之间发生相互作用, 经泛素化被蛋白酶体降解的小分子。与PROTAC不同的是, 分子胶对E3泛素连接酶和靶蛋白具有双配体结构特征,兼具同两个蛋白结合的功能, 促进两个蛋白发生泛素化, 对那些非可药性靶标以及蛋白-蛋白相互作用也可因之而降解。人们认为PROTAC是理性设计的产物,分子胶降解剂是幸运发现的, 其实后者是对那些偶然发现的药物经作用机制研究而揭示出的。分子胶具有分子量更小,化学机构更简单,空间干扰少(relaxed steric interference)和成药性更好的特点。但毋庸置疑的是,分子胶无法像PROTAC那样通过对各组分的大规模筛选来实现,它的设计会比PROTAC难很多。确定分子胶化合物需要广泛的理性研究, 包括结构生物学、生物化学、生物物理学、谱学和基因变异组学等[1]。
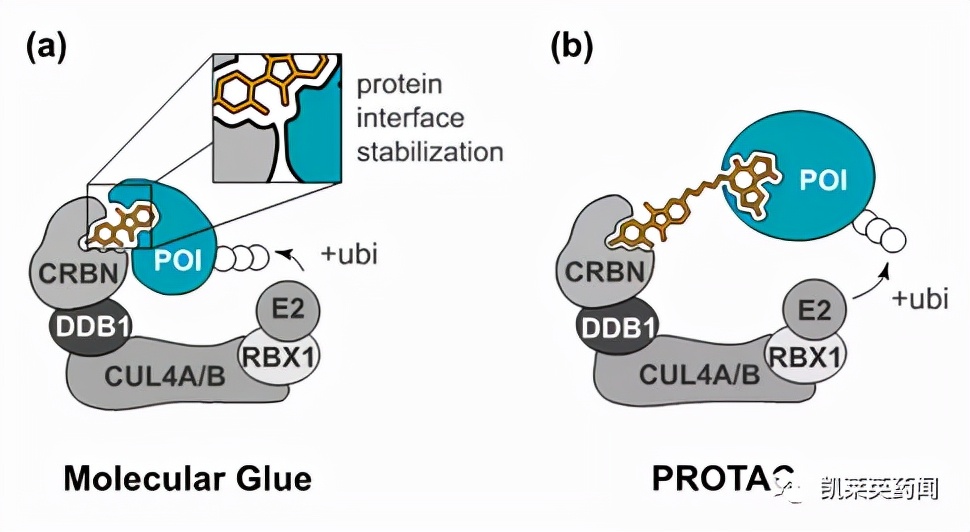
图片来源:Targeted Protein Degradation
一、分子胶的发现及种类
01
天然药物的分子胶
最早的药物发现源于哈佛大学S. Schreiber等人在1991年进行的结合两个蛋白引发生物效应的研究,环孢菌素A (cyclosporin A, CsA) 和他克莫司(tacrolimus, FK506)分别属于环肽和大环内酯的结构类型, 结合的受体蛋白分别是亲环素(cyclophilin) 和FK结合蛋白(FKBP), 但发现后继的分子机制却是相同的, 都结合钙调磷酸酶(calcineurin)形成三元复合物, 钙调磷酸酶是依赖钙/钙调素的磷酸酶的催化亚基, 选择性地水解蛋白中丝/苏氨酸上的磷酸基。环孢菌素A和他克莫司犹如分子胶分别将各自的靶标蛋白与钙调磷酸酶“粘黏”在一起, 导致靶标的抑制, 这是最早被称作分子胶的药物[2,3]。另一个具有免疫抑制作用的抗生素雷帕霉素(rapamycin)也结合于FKBP, 用亲合色谱证明雷帕霉素-FKBP结合于哺乳动物雷帕霉素靶标蛋白(mTOR)。mTOR是细胞生长和增殖的重要因子, 它的变异与肿瘤密切相关。由于雷帕霉素介导非可药性靶标mTOR生成FKBP-rapa-mTOR三元复合物, 认为其扮演了分子胶的角色。上述天然药物介导两个蛋白的相互作用, 形成的三元复合物阻断了靶蛋白的功能,蛋白并没有被降解,所以它们被称之为分子胶[4,5]。
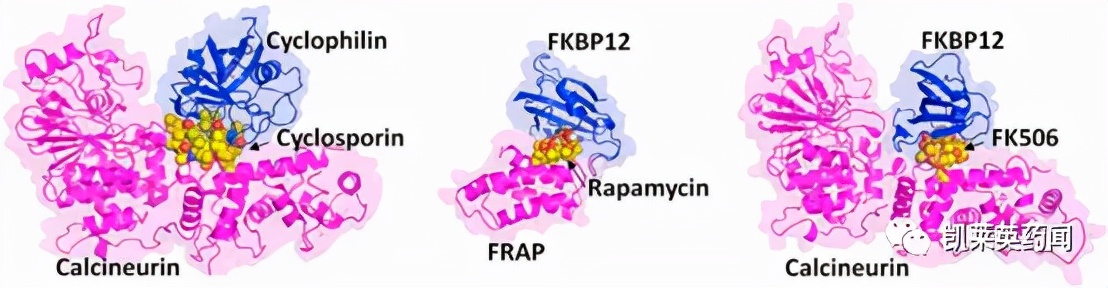
图片来源:Science Direct
02
来那度胺
B. Ebert等[6]在2014年报道了第一个发挥蛋白质降解作用的分子胶降解剂来那度胺(lenalidomide),研究发现来那度胺结合于泛素E3连接酶CUL4-CRBN蛋白上,呈现多效性反应, 是由于靶蛋白的泛素化而引发的。作为E3连接酶的CUL4具有特异性,被CRBN的蛋白所调控。此外,来那度胺以及类似物沙利度胺(thalidomide) 和泊马度胺(pomalidomide)等还可以同该连接酶的其他蛋白结合, 例如介导对酪蛋白激酶1α (CK1α) 的降解反应, 揭示了来那度胺治疗与染色体5q缺失相关骨髓增生异常综合征[del (5q) MDS] 的作用机制[7]。
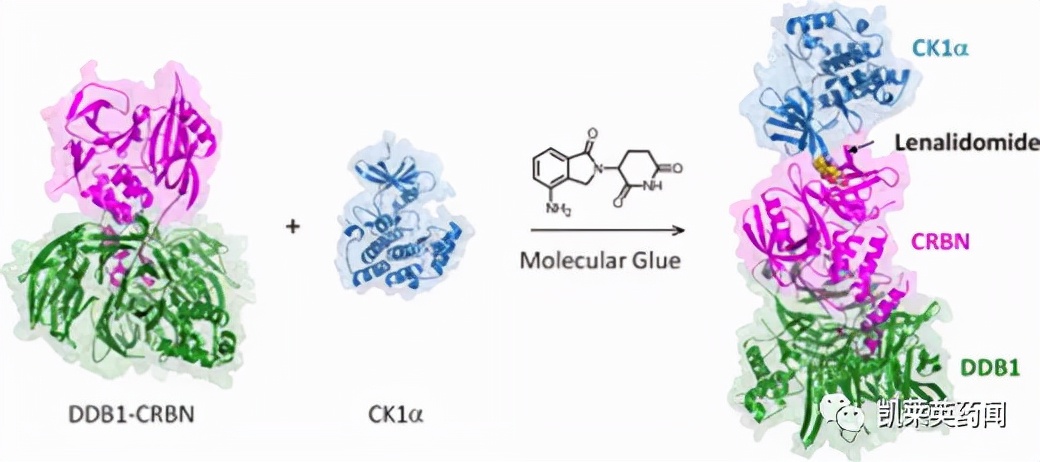
图片来源:Science Direct
03
吲地苏兰
吲地苏兰(indisulam, E7070) 是碳酸酐酶抑制剂, 具有抗肿瘤活性, 是作用于细胞周期G1期的靶向化合物, 对移植人肿瘤细胞的小鼠有显著抑制作用, 且具有安全性。用重组的纯化蛋白RBF39、E3连接酶的DCAF15等蛋白与吲地苏兰温孵, 得到三元复合物RBF39-indisulan-DCAF15, 没有生成任何的二元复合物, 说明吲地苏兰是连接靶标与E3连接酶的“两面胶”型的关键分子。变异的RBF39不能被吲地苏兰识别与结合, 分子胶失去了“黏合”能力, 因而表现为临床的耐药性。另外,两个苯磺酰胺化合物塔西苏兰(tasisulam) 和CQS与吲地苏兰的作用机制是相同的[8]。
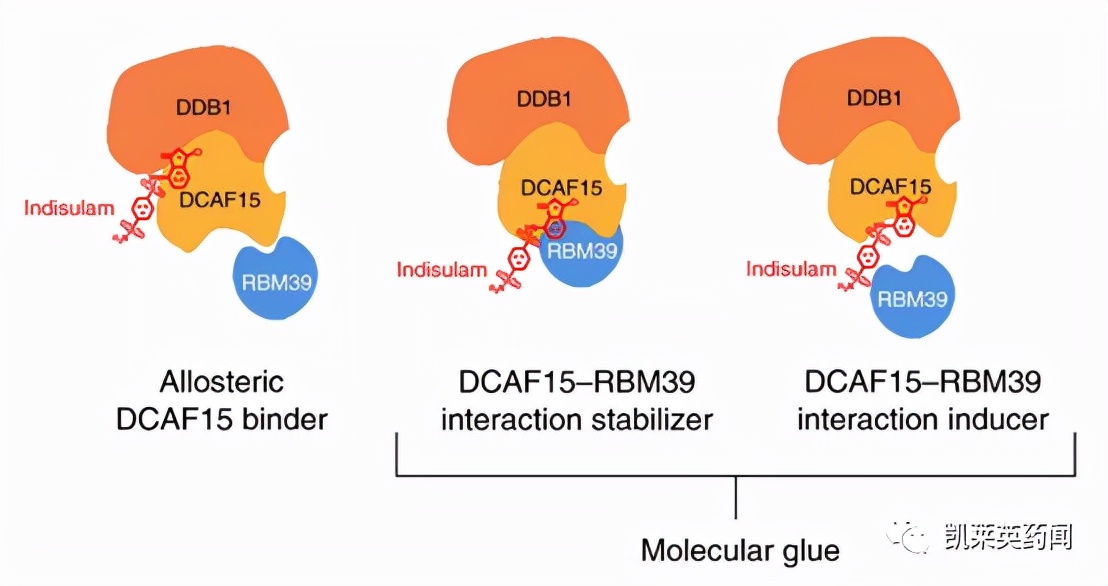
图片来源:文献[8]
04
化合物CR8
前面的范例是在已知抗肿瘤活性的机制研究基础上揭示出的分子胶, 可谓由偶然发现得来的,化合物CR8则是有目的筛选而发现的。Sabicki等[9]将4518个药物或临床前小分子与578株肿瘤细胞温孵, 测定了499株细胞中E3泛素连接酶的mRNA水平, 发现由于CR8的作用,肿瘤细胞中DCAF15蛋白的表达水平降低, 这与CUL4衔接蛋白DDB1的mRNA水平相关联。CR8作为分子胶, 结合于CDK12-cyclin K, 并与E3连接酶CUL4的衔接蛋白DDB1之间形成复合物, 从而使cyclin K发生泛素化, 继之将其降解而杀伤肿瘤。在此,CR8参与的蛋白-蛋白相互作用绕过了对底物受体的互补性要求。
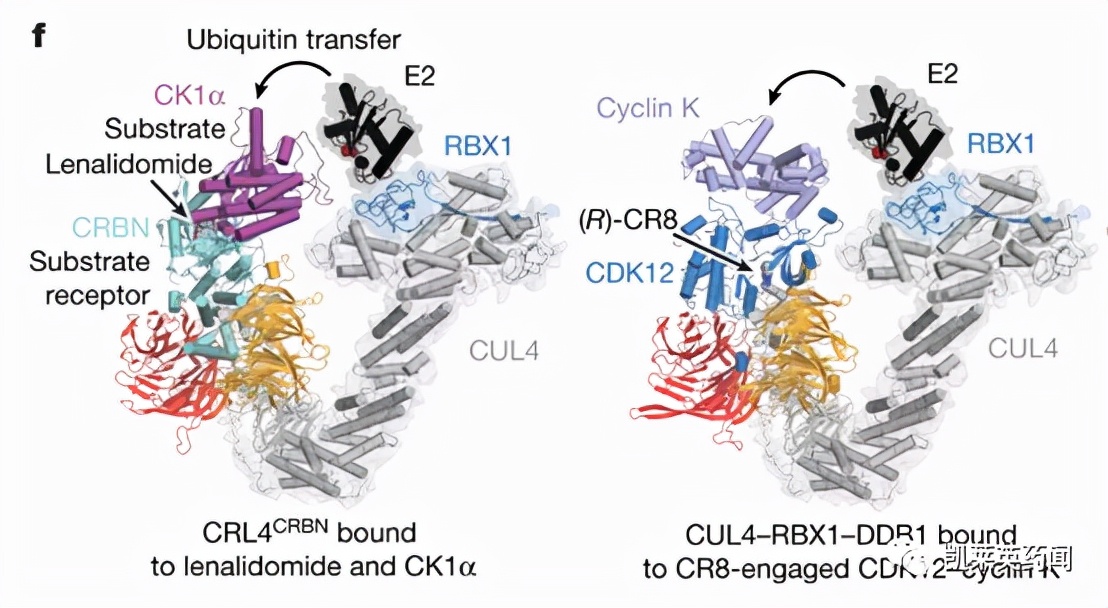
图片来源:文献[9]
05
聚酮类共价结合的分子胶
阿斯卡霉素(asukamycin)是链霉菌属代谢产物, 属于聚酮类抗生素, 能抑制肿瘤细胞增殖活性。研究表明[10],阿斯卡霉素可通过结合UBR7和TP53的分子间胶合, 介导了TP53的抑癌作用而发挥作用, 所以是另一类分子胶。此外,另一个天然聚酮甘露霉素(manumycin A) 是阿斯卡霉素的类似物, 结构中也具有多个亲电性位点,对UBR7和TP53两个蛋白也起着分子胶的作用, 强度也与阿斯卡霉素相近。
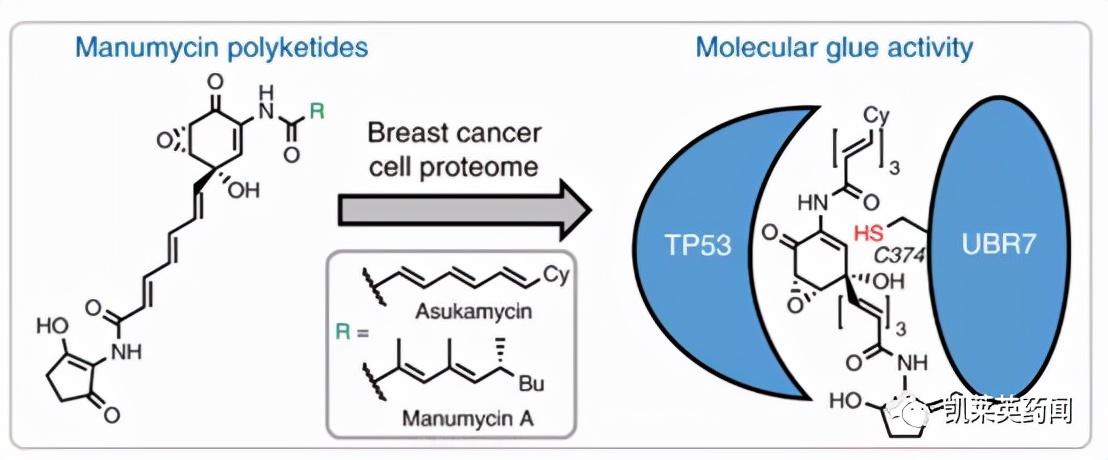
图片来源:文献[10]
二、分子胶的最新研究进展
据不完全统计,现将目前处于在研阶段的分子胶统计如下:
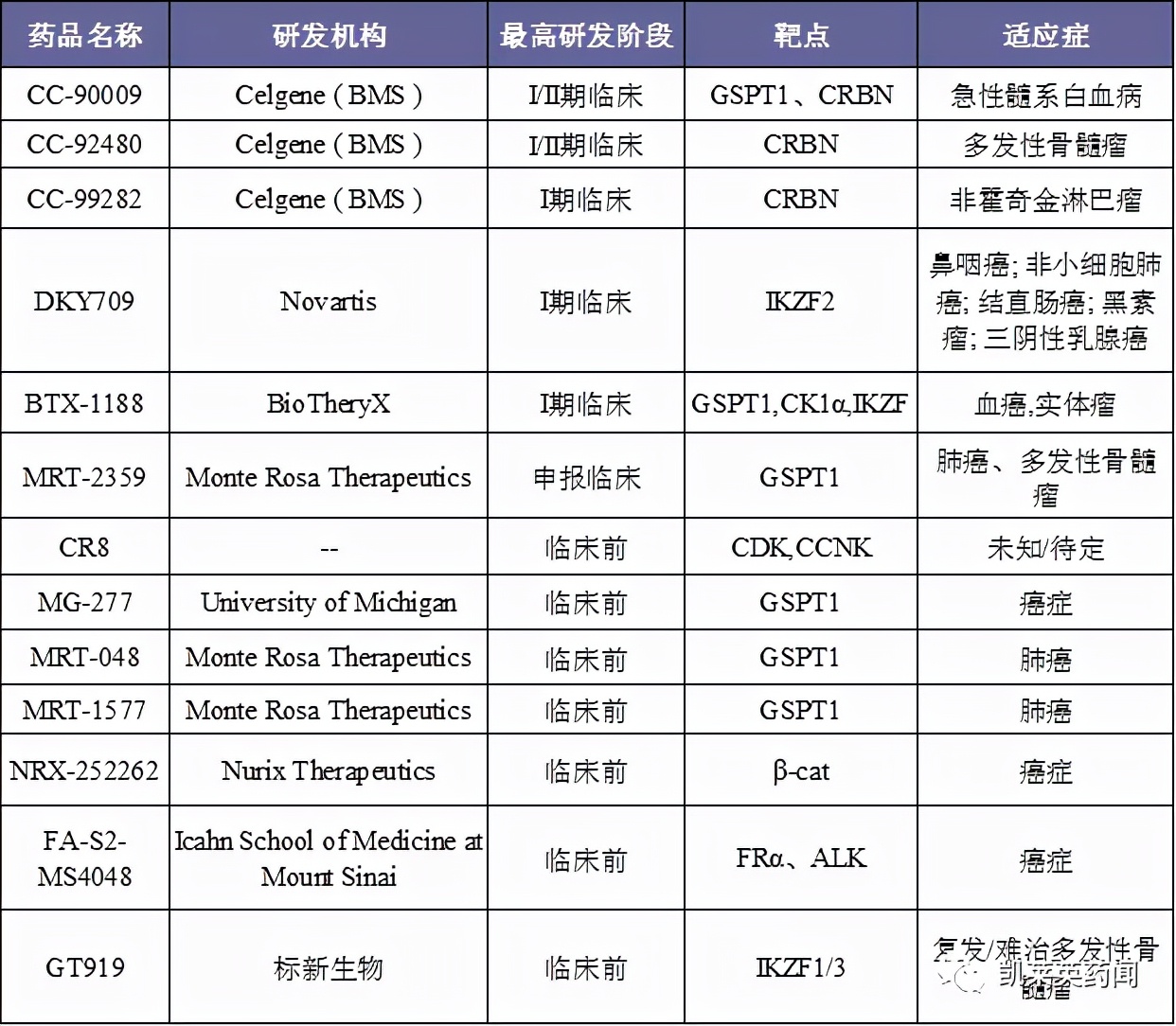
三、部分企业及药物介绍
01
BMS:CC-90009
大多数小分子依靠配体与蛋白的相互作用获得活性,而分子胶降解剂是通过调节蛋白与蛋白的界面捕获其靶点,Ikaros和Aiolos都是锌指转录因子,由于缺乏催化活性位点,属于难以用小分子进行药物治疗的靶点。然而分子胶降解剂可作用于新的靶点,包括异双功能降解剂无法达到的靶点[11]。BMS的鸟苷三磷酸酶CC-90009可最大程度地降解细胞周期G1到S期的转换1基因(GSPT1),并最大程度地降低Ikaros、Aiolos和其他与毒性相关的新底物的降解。2021年4月,《血液》杂志报道[12],CC-90009还能杀死急性髓细胞白血病(AML)胚细胞和白血病干细胞。2021年10月,与AbbVie合作开发,针对AML受试者的安全性和有效性的1/2期临床试验由于风险/收益的不利变化,目前处于暂停状态。

02
诺华:DKY709
诺华公司开发的分子胶降解剂DKY709可与另一个锌指转录因子Helios结合。2021年6月,DKY709单药治疗或与PDR001联合治疗晚期实体瘤患者的 I/Ib期、开放标签、多中心研究正在进行中,评估在先前接受过抗PD-1/PD-L1治疗的非小细胞型肺癌(NSCLC),黑色素瘤,或鼻咽癌(NPC)受试者中的安全性和耐受性。在确定特定治疗组的最大耐受剂量/推荐剂量(MTD/RD)后,剂量扩展将进一步评估每个方案在MTD/RD的安全性、耐受性、PK/PD和抗肿瘤活性。

03
BioTheryX:BTX1188
BioTheryX是一家临床阶段的生物制药公司,致力于降解蛋白以制造可挽救生命的抗癌药物。2021年11月,FDA批准BTX-1188在血液系统和实体恶性肿瘤开展1期临床试验。BTX-1188是一种新型口服小分子脑结合剂,具有免疫调节特性并促进GSPT1、翻译终止因子以及 IKZF1/3、锌指转录因子的降解血液学功能,通过降解包括GSPT1和IKZF1/3在内的多种蛋白质,BTX-1188有望与专门针对GSPT1的蛋白质降解剂区分开来。BTX-1188已证明对多种白血病和实体瘤具有良好的临床前活性。使用MV-411人AML裸鼠异种移植模型评价BTX-1188的体内疗效,研究表明间歇性给药可显著减少肿瘤体积,进一步确定治疗候选患者AML的可能性。重要的是,BTX-1188在不到两周的剂量内完全消除了肿瘤,并在研究结束前保持动物无肿瘤状态。
BioTheryX研发管线

图片来源:BioTheryX官网
04
Monte Rosa Therapeutics:MRT-2359
Monte Rosa于2021年6月份在纳斯达克上市,通过蛋白降解平台QuEEN分析靶标蛋白分子表面特征,是第一家专注于分子胶开发的上市公司。根据近期发布的第三季度季报,其口服分子胶GSPT1降解剂MRT-2359已经启动IND研究,并期待在2022年年中向FDA提交IND,它的适应症是过度表达MYC家族基因的一类癌症。MYC转录因子是最常发生突变、易位和过度表达的致癌基因之一,高度依赖蛋白质翻译,而GSPT1在蛋白质合成中发挥重要角色。根据公司官网,临床前数据显示口服GSPT1药物在选择性、耐受性方面表现良好,已被证明在非小细胞肺癌、小细胞肺癌和多发性骨髓瘤的多个MYC驱动的临床前模型中诱导肿瘤消退。
Monte Rosa的研发管线
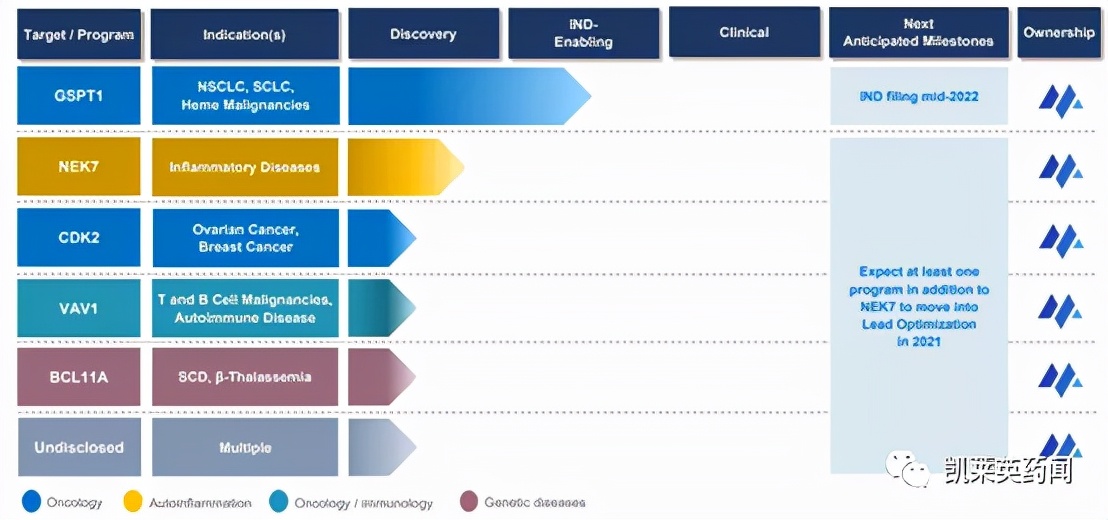
图片来源:Monte Rosa官网
05
分迪药业
分迪药业是中国首家将“AI+PROTAC+分子胶”有机结合开发新药的公司,已建立专有PRODED靶向蛋白降解药物平台,并利用此平台开发免疫新疗法的小分子创新药物,以期治愈癌症和病毒感染性疾病。目前,该公司尚未有进入临床阶段的药物。
分迪药业研发管线
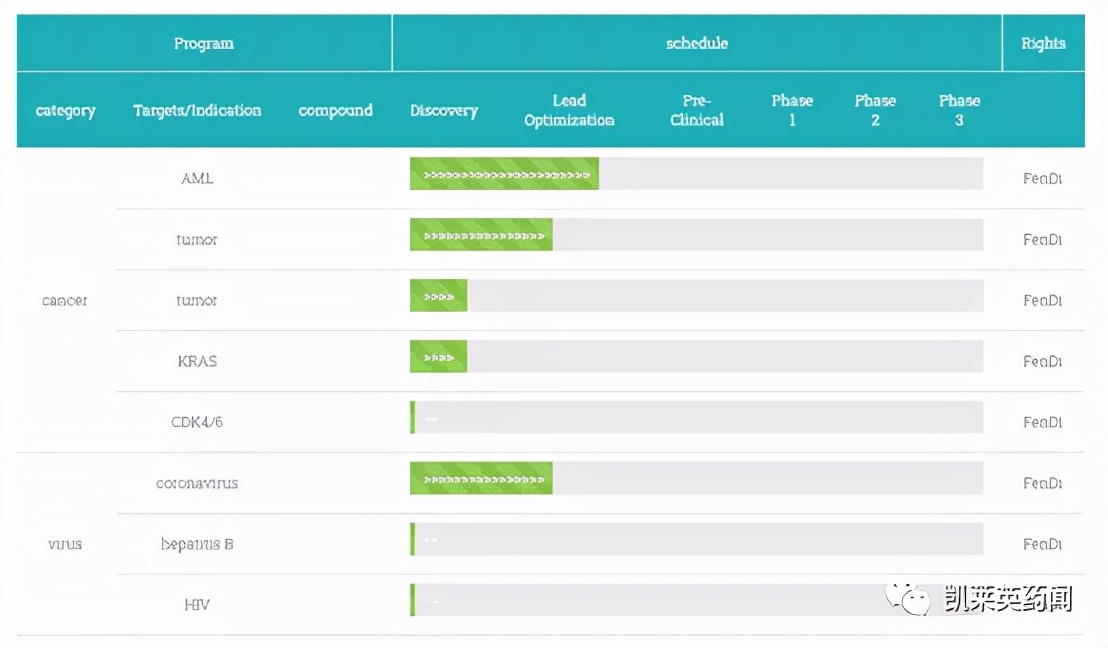
图片来源:分迪官网
06
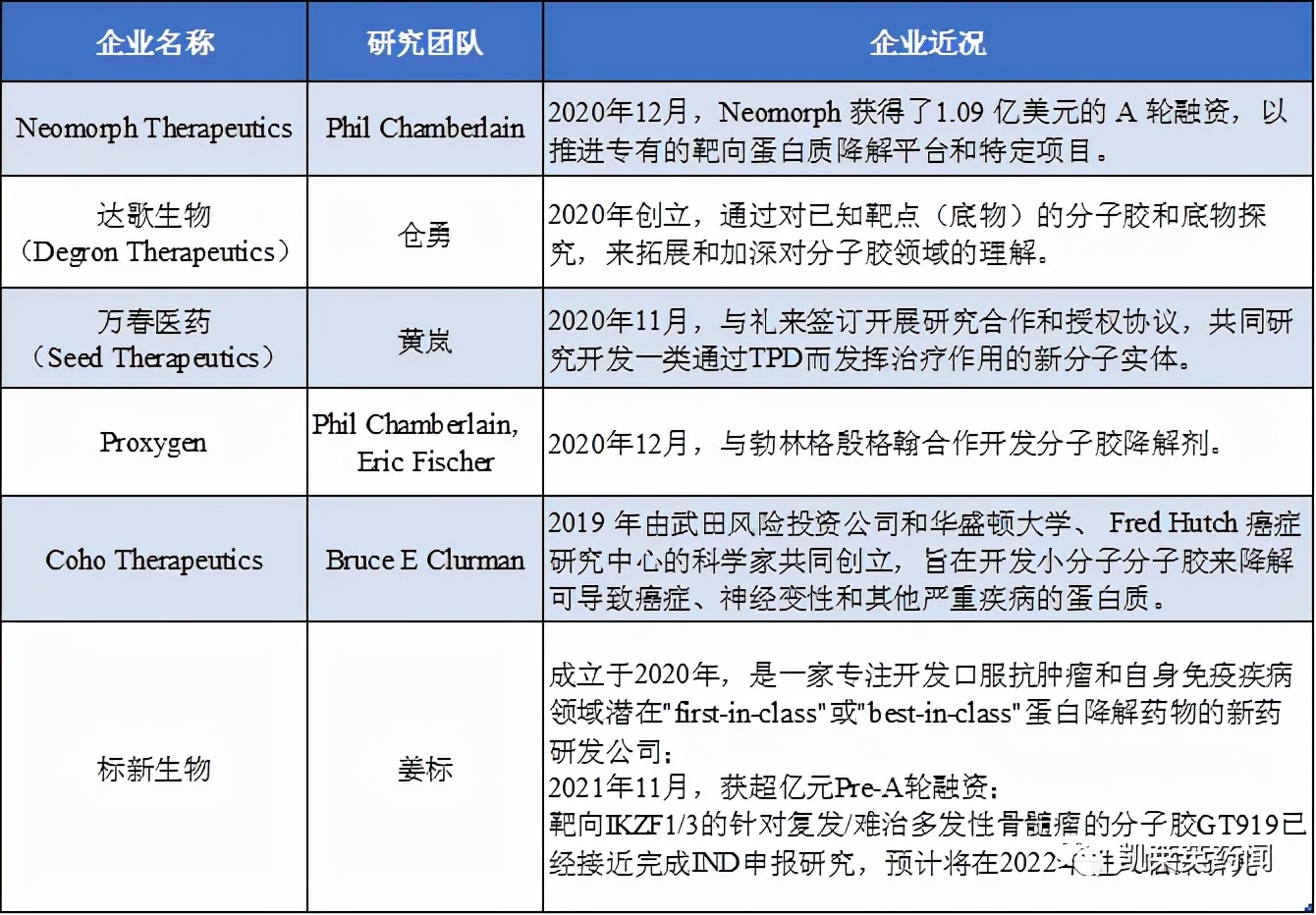
其它分子胶企业的最新进展
参考文献
[1]郭宗儒.药物中的分子胶[J].药学学报,2021,56(10):2682-2688.
[2] Liu J , Farmer J D , Lane W S , et al. Calcineurin is a common targetof cyclophilin-cyclosporin A and FKBP-FK506 complexes.[J]. Cell, 1991,66(4):807-815.
[3] Schreiber S L . The Rise of Molecular Glues[J]. Cell, 2021, 184(1):3-9.
[4] Heinz,Fretz, Mark, et al. Rapamycin and FK506 binding proteins (immunophilins)[J].Journal of the American Chemical Society, 1991.
[5] Heitman J M , Movva N R , Hall M N . Heitman J, MovvaNR, Hall MN. Targets for cell cycle arrest by the immunosuppressant rapamycinin yeast. Science 253: 905-909[J]. Science, 1991, 253(5022):905-909.
[6] Lenalidomide Causes Selective Degradation of IKZF1 andIKZF3 in Multiple Myeloma Cells[J]. Science, 2014, 343(6168):301-5.
[7] Lenalidomide induces ubiquitination and degradation ofCK1α in del(5q) MDS[J]. Nature, 2015, 523(7559).
[8] Bussiere D E , Xie L , Srinivas H , et al. Structuralbasis of indisulam-mediated RBM39 recruitment to DCAF15 E3 ligase complex[J].Nature Chemical Biology, 2020, 16(1).
[9] Sabicki M , Kozicka Z , Petzold G , et al. The CDKinhibitor CR8 acts as a molecular glue degrader that depletes cyclin K[J].Nature.
[10] Isobe Y , Okumura M , Mcgregor L M , et al. Manumycinpolyketides act as molecular glues between UBR7 and P53[J]. Nature ChemicalBiology, 2020.
[11] MullardA . Targeted protein degraders crowd into the clinic[J]. Nature Reviews DrugDiscovery, 2021, 20(4).
[12] Surka C, Jin L, Mbong N, et al. CC-90009, a novelcereblon E3 ligase modulator, targets acute myeloid leukemia blasts andleukemia stem cells[J]. Blood, 2021, 137(5): 661-677.







